依据固定相的形式,CEC可分为填充柱(PC-CEC)、整体柱(MC-CEC)和开管柱(OT-CEC)三大类。PC-CEC通常是将各类分离介质填充于毛细管内,再经过两端柱塞烧结来制备的。Fei等[28]采用加压填充法将手性MOF [In3O(obb)3(HCO2)(H2O)]晶体直接装填于毛细管内,在CEC模式下,实现了克仑特罗、氢化安息香等手性对映体以及硝基酚同分异构体的快速有效分离。但PC-CEC的分离性能易受填料粒径分布、形貌差异等因素的影响,且制备过程较为复杂,目前已逐渐被MC-CEC和OT-CEC所取代。Ding等[29]采用层层自组装原理在聚合物整体柱内原位生长ZIF-8晶体涂层,再利用戊二醛交联原理在ZIF-8晶体表面键合胃蛋白酶分子,所制得的pepsin-ZIF-8-poly(GMA-co-EDMA)整体柱对羟氯喹、氯喹、羟嗪等手性药物的CEC拆分效果显著。Miao等[30]采用相似的策略成功制备了pepsin@MOF-5@poly(GMA-co-EDMA)整体毛细管柱,并利用其成功实现了奈福泮、克仑特罗及氯苯那敏等6种碱性手性药物的CEC手性拆分。Zhang等[31]将镧系金属MOF(NKU-1)分散至预聚合混合物中,并将该混合溶液通入毛细管内,采用前驱体掺杂MOFs原位聚合策略成功制备了NKU-1-poly (BMA-co-EDMA)整体柱,实现了对烷基苯、多环芳烃等多类化合物的高效CEC分离。MOFs改性MC-CEC的固定相载量较大,易于获得较高的分离选择性,但该模式普遍存在柱压较高、重现性较差、毛细管易堵塞等问题,一定程度上限制了MC-CEC的应用。
相比于填充柱和整体柱,OT-CEC的固定相制备方法更加灵活多样,且与新型色谱分离介质更加兼容,已逐渐发展成为一类主流的CEC固定相制备方式。然而,开管模式的固定相负载量有限,导致OT-CEC柱的容量较小且分离选择性受限。因此,迫切需要开发具有高负载量和更大柱容量的新型OT-CEC固定相。MOFs具备改善固定相传质性能和增加作用位点数量的双重优势,在OT-CEC领域已得到广泛应用。迄今为止,MOFs用于构建OT-CEC固定相的制备方法主要包括物理涂覆法、化学键合法和原位生长法等。
物理涂覆法是一种后修饰固定方法,依靠范德华力、氢键或静电作用等非共价键相互作用力将MOFs涂层覆盖在毛细管内壁上。该类方法制备过程简便,易于实现,适用于多数MOFs材料。Wang等[32]利用静电吸附将BSA与ZIF-8结合修饰于毛细管内壁,在CEC模式下成功分离了多种同系物和异构体。Zhang等[33]采用相似的方法制备了组氨酸修饰的ZIF-8涂层毛细管柱,成功分离了3种外消旋碱性药物的对映体。研究发现,该手性MOFs能够与β-环糊精(β-CD)起到协同作用,与不含His-ZIF-8的CM-β-CD毛细管柱相比,His-ZIF-8柱的分离选择性显著提升。硅酸钠作为一种良好的无机黏附剂,可显著增强MOFs晶体与毛细管内壁的结合能力。Fei等[34]利用硅酸钠的黏附作用将手性MOFs材料[Zn2(D-Cam)2(4,4'-bpy)]n均匀、致密地固定于毛细管内表面,并利用该手性涂层柱实现了黄酮和吡喹酮的CEC基线分离。此外,陈子林课题组[35]利用聚多巴胺(PDA)的多活性基团和强黏附特性,将预先合成的γ-CD-MOF(Cu-SD)涂覆在PDA改性毛细管内,得到的Cu-SD改性柱对丹酰化氨基酸对映体具有良好的手性分离效果。然而,物理涂覆方法所得MOFs改性OT-CEC柱的涂层结合力不强,易脱落且化学稳定性欠佳。
化学键合法主要通过使用硅烷偶联剂等连接剂,基于共价作用将MOFs固定在毛细管内壁。相较于物理涂覆法,化学键合法具有更高的固定强度,可以在一定程度上改善MOFs涂层的稳定性。Ye课题组[36]利用氨丙基三乙氧基硅烷(APTES)所携带氨基与MOFs晶体表面不饱和配位羧基基团间的酰胺缩合反应,首先制备得到APTES改性Mn(cam)(bpy),再利用硅烷偶联原理将该APTES改性MOFs晶体共价键合于毛细管内壁,进而将该Mn(cam)(bpy)涂层柱成功用于多种磺胺类化合物的CEC分离分析(图5)。此外,Ma等[37]通过甲基丙烯酸缩水甘油酯共聚物与组氨酸改性ZIF-67在毛细管内表面的化学键合,在常温条件下制备了组氨酸改性ZIF-67毛细管电色谱固定相。Sun等[38]采用共价交联策略制备了一种脂肪酶与MIL-100(Fe)相结合的复合材料,再使用3-三甲氧基丙基甲基丙烯酸酯(γ-MAPS)作为交联剂将该复合材料固定在毛细管内壁,通过CEC模式实现了多类对映体化合物的有效分离。化学键合法虽然可有效提高毛细管柱内壁涂层的稳定性,但由于其制备过程复杂且需要特定反应活性的官能团,仍存在一定的局限性。
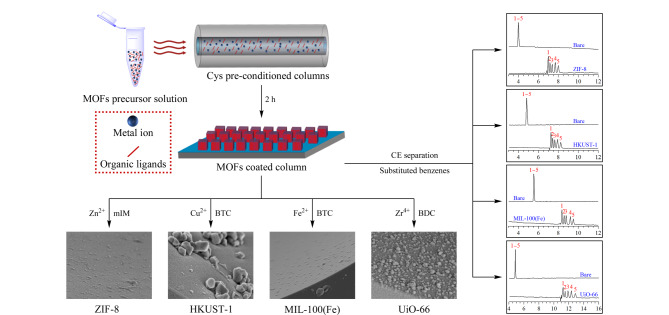
图 5. Mn(cam)(bpy)涂层柱的制备及应用示意图[36].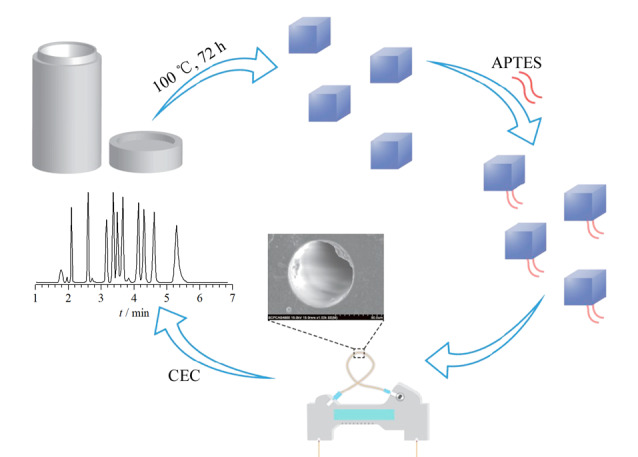
由于流动相对管壁的剪切力较强,相比于开管MOFs涂层GC柱,OT-CEC模式对MOFs固定相的涂层牢固性有着更高要求。与前述后修饰方法不同,原位生长法直接在毛细管内壁表面进行MOFs成核生长,有助于显著提升MOFs涂层与管壁的结合能力。Sun等[39]采用原位生长策略成功制备了L-组氨酸(L-His)改性MIL-53涂层柱。该方法首先将APTES、戊二醛以及高锰酸钾溶液依次通入毛细管中,得到羧基改性柱,然后通入MOFs前驱体溶液,在一定条件下于管壁界面原位生长NH2-MIL-53晶体,再利用酰胺缩合反应对所得MOFs涂层进行L-His改性,所得L-His-NH-MIL-53改性CEC柱对部分外消旋药物展现出较强的手性拆分能力。Zheng等[40]基于相似的制备策略,首先在毛细管壁原位生长NH2-MIL-53,再对其进行环糊精后修饰,所制得的Cyclodextrin-NH-MIL-53涂层柱对手性氨基酸呈现较好的手性拆分能力。本研究组受半胱氨酸(Cys)可有效诱导加速MOFs晶体成核的启发,发展了一种高效、通用的MOFs涂层固定相制备方法,即固定化半胱氨酸诱导原位生长(ICISG)[41],可用于多种MOFs涂层毛细管固定相的高效制备(图6)。以4种由不同金属离子(Zn2+、Cu2+、Fe3+、Zr4+)组成的MOFs为例,采用ICISG策略,ZIF-8等MOFs晶体可快速生长于Cys改性毛细管内壁上,中性、酸性和碱性化合物在4种MOFs涂层柱上均实现了高效CEC基线分离。基于该ICISG策略,我们进一步制备了具有均一介孔结构的mesoMOF-1涂层柱[42],并用于高效CEC分离分析。相较于HKUST-1涂层柱,mesoMOF-1涂层柱能更加有效地平衡各类分析物自身的动力学扩散及与介孔孔道间的热力学相互作用,成功实现了7种不同分子尺寸化合物的高效分离分析,理论塔板数高达1.4×105板/米。此外,Li等[43]基于前驱体掺杂聚合原理,将CAU-1掺入聚甲基丙烯酸甲酯(PMMA)前驱体溶液中,在管壁表面原位聚合成功制得CAU-1@PMMA涂层PLOT柱,进而对芳香酸类化合物实现了更高柱效的CEC分离分析。尽管原位生长方法在MOFs涂层OT-CEC固定相开发中已展现出巨大的应用价值,但该策略在涂层方法学适用性和重现性等方面仍存在较大缺陷。进一步探索和发展简便、普适性强、结晶性优异且具有良好重现性的MOFs涂层OT-CEC固定相构建新方法具有重要意义。
图 6. ICISG策略用于制备MOFs涂层柱[41].